Thermodynamique chimique
- Cours (CM) 12h
- Cours intégrés (CI) -
- Travaux dirigés (TD) 12h
- Travaux pratiques (TP) -
- Travail étudiant (TE) -
Langue de l'enseignement : Français
Description du contenu de l'enseignement
Introduire le langage et les notions de bilan énergétique, liés à l'approche thermodynamique, puis acquérir les connaissances nécessaires au traitement d'un problème de thermodynamique sur un système chimique idéal à l'équilibre, dans l'état standard et dans les conditions de température T et pression P quelconques. Appliquer les concepts de la thermodynamique à l’étude de la réactivité chimique. Aspect phénoménologique de la thermodynamique : structure de la matière, 1ère et 2ème lois de la thermodynamique, changement d'état : matériaux purs, mélanges, diagrammes de phase, réaction chimique, modèles thermochimiques.
Thermodynamique appliquée à l’étude de réactions chimiques
Le premier principe de la thermodynamique : Energie interne, enthalpie, capacité calorifique
Le second principe de thermodynamique : Entropie et désordre. Spontanéité. Entropie standard en fonction de la température. Interprétation microscopique de l'entropie.
Enthalpie libre – Energie libre : Relation avec la spontanéité. Influence de la température sur la spontanéité.
Équilibre chimique et thermodynamique : Potentiel chimique. Notion d’activité (solutions idéales et réelles). Lien avec la constante d'équilibre. Déplacement des équilibres au changement des conditions. Relation de van't Hoff (influence de T sur la constante d’équilibre).
Équilibre électrochimique : Relation de NERNST.
Systèmes à un constituant : diagramme d'état d'un corps pur : Diagrammes P-T d'un système à un constituant. Règle des phases de Gibbs.
Systèmes à plusieurs constituants : Diagramme de phases à deux constituants (deux composés miscibles à l’état liquide).. Règle des phases pour plusieurs constituants. Construction des diagrammes de phases au départ des courbes d'enthalpies libres : règle des tangentes communes. Lecture de s diagrammes de phases : règle du levier.
Propriétés colligatives des solutions : cryoscopie, ébullioscopie. Entropie de mélange et enthalpie libre pour solutions régulières. Applications et illustrations par des diagrammes de phases binaires (liquide-gaz, liquide-solide, solide-solide).
Thermodynamique appliquée à l’étude de réactions chimiques
Le premier principe de la thermodynamique : Energie interne, enthalpie, capacité calorifique
Le second principe de thermodynamique : Entropie et désordre. Spontanéité. Entropie standard en fonction de la température. Interprétation microscopique de l'entropie.
Enthalpie libre – Energie libre : Relation avec la spontanéité. Influence de la température sur la spontanéité.
Équilibre chimique et thermodynamique : Potentiel chimique. Notion d’activité (solutions idéales et réelles). Lien avec la constante d'équilibre. Déplacement des équilibres au changement des conditions. Relation de van't Hoff (influence de T sur la constante d’équilibre).
Équilibre électrochimique : Relation de NERNST.
Systèmes à un constituant : diagramme d'état d'un corps pur : Diagrammes P-T d'un système à un constituant. Règle des phases de Gibbs.
Systèmes à plusieurs constituants : Diagramme de phases à deux constituants (deux composés miscibles à l’état liquide).. Règle des phases pour plusieurs constituants. Construction des diagrammes de phases au départ des courbes d'enthalpies libres : règle des tangentes communes. Lecture de s diagrammes de phases : règle du levier.
Propriétés colligatives des solutions : cryoscopie, ébullioscopie. Entropie de mélange et enthalpie libre pour solutions régulières. Applications et illustrations par des diagrammes de phases binaires (liquide-gaz, liquide-solide, solide-solide).
Compétences à acquérir
Bases de la thermodynamique
Thermodynamique chimique
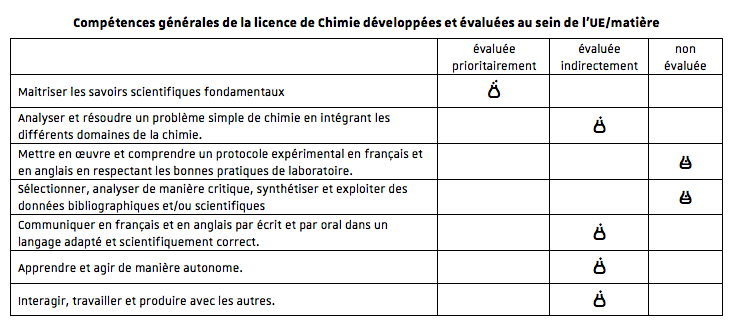
- Identifier grandeur et variable d'état.
- Distinguer les grandeurs extensives et intensives.
- Rappel du premier principe de la thermodynamique.
- Maîtriser le formalisme des concepts associés (énergie interne, chaleur, température de flamme)
Thermodynamique chimique
- Connaître le second principe de la thermodynamique et les concepts associés (entropie, états de la matière macroscopique, chaleur, température) et les appliquer à l’étude de la réactivité chimique.
- Comprendre et utiliser les notions d’énergie de Gibbs et de potentiel chimique.
- Calculer la variation de l’énergie de Gibbs dans une réaction chimique.
- Comprendre les notions de transition de phase, d'équilibre thermique (température), et mécanique (pression).
- Calculer la variance associée à un état d’équilibre.
- Lire un diagramme binaire.
- Connaître et appliquer les lois de Raoult et Henry.
- Calculer une pression osmotique et une solubilité.
Contact
Faculté de chimie
1, rue Blaise Pascal - BP 2029667008 STRASBOURG CEDEX
0368851672
Formulaire de contact
Responsable
Remi Barillon